Chirurgie assistée complète en cabinet avec modèles sélectifs ouverts sur les dents : Étude clinique prospective sur 20 patients
1.Introduction
À ce jour, les implants dentaires représentent une solution efficace et prévisible pour la réadaptation prothétique des patients partiellement et totalement édentés, avec des taux de survie et de réussite élevés à court et à long terme.
Au cours des dix dernières années, la grande prévisibilité et la rentabilité des implants dentaires ont contribué à la diffusion de l’implantologie orale dans le monde entier. Par conséquent, l’implantologie n’est plus la prérogative de quelques professionnels spécialisés comme elle l’était, mais est devenue une technique courante gérable par presque tous les professionnels dentaires.
Pourtant, l’insertion d’implants dans la bonne position, à la bonne profondeur et à la bonne inclinaison reste assez complexe, et l’implantologie ne peut pas être définie comme sans risque pour le praticien.
En fait, l’invasion de structures anatomiques comme le nerf alvéolaire inférieur ou le sinus maxillaire peut avoir de graves conséquences, tant pendant la préparation du site de l’implant que pendant l’insertion de l’implant, notamment les paresthésies et les infections. L’invasion de l’espace parodontal des racines adjacentes de la dent est elle-même un événement à éviter, qui peut déterminer la perte de vitalité de la dent blessée et la défaillance de l’implant. La perforation de la paroi osseuse linguale de la mandibule antérieure peut être encore plus dangereuse, ce qui peut entraîner de graves lésions vasculaires qui peuvent mettre en danger la vie du patient.
En outre, le positionnement incorrect d’un implant peut entraîner des complications esthétiques (en particulier dans le maxillaire antérieur, où une insertion trop buccale peut entraîner une résorption osseuse marquée et une défaillance esthétique) ou de graves difficultés prothétiques, qui aboutissent à des compromis biologiques et fonctionnels. De tels compromis se produisent dans le cas d’implants placés trop près des dents adjacentes, ou trop près les uns des autres, ou avec des inclinaisons incorrectes, ce qui rend la restauration prothétique appropriée difficile pour le technicien dentaire.
La chirurgie d’implant guidée aujourd’hui peut représenter la solution à tous ces problèmes. La chirurgie d’implant guidée statique est une technique qui consiste à positionner les implants dentaires de façon guidée, au moyen d’un gabarit chirurgical, ce qui transfère un processus de planification tridimensionnelle (3D) informatisé au contexte clinique. L’implant est donc inséré dans la position, l’inclinaison et la profondeur prévues dans le logiciel 3D.
La chirurgie guidée présente plusieurs avantages : outre le contrôle de la position, de la profondeur et de l’inclinaison de l’implant, il est possible d’insérer les implants de façon souple (c.-à-d. sans avoir à soulever un lambeau mucopériosté). Cela réduit la douleur post-opératoire du patient et simplifie l’intervention. Cette approche mini-invasive permet de préserver la microcirculation périoste, avec des avantages potentiels pour la stabilité des tissus.
Malgré ces avantages, cependant, à ce jour, seulement une petite fraction des chirurgiens utilisent systématiquement la chirurgie guidée.
Les raisons de cette faible utilisation se trouvent surtout dans le coût de production élevé des gabarits chirurgicaux, qui sont généralement fabriqués par des entreprises externes d’implantologie ou des laboratoires dentaires spécialisés. Pour cette raison, les chirurgiens n’utilisent ces technologies que dans le cas d’implants multiples et de cas complexes, dans lesquels le coût de production du guide est pleinement justifié par le nombre d’appareils insérés. Un deuxième facteur important qui limite l’utilisation de la chirurgie guidée est l’exactitude insatisfaisante de plusieurs modèles chirurgicaux qui sont actuellement disponibles sur le marché. Plusieurs recensions ont en effet montré comment un écart assez important (en moyenne plus de 1 mm) se produit entre la position prévue des implants dans le logiciel 3D et leur position réelle après insertion.
En fait, de nombreuses erreurs peuvent se produire, de l’acquisition d’images à la planification de l’implant, et de la production des modèles à la procédure chirurgicale. Ces erreurs finissent inévitablement par compromettre la précision finale des modèles chirurgicaux.
Parmi ceux-ci, l’un des éléments les moins pris en considération mais les plus importants est celui de la conception et de la fabrication de gabarits chirurgicaux; en particulier, une forme incorrecte du gabarit ne permet pas d’obtenir une stabilité adéquate, même dans un cas où de puissantes imprimantes 3D industrielles sont utilisées pour la fabrication des guides.
L’objectif de cette étude clinique prospective est de présenter les résultats obtenus avec des modèles chirurgicaux soutenus par des dents caractérisés par une conception ouverte innovante avec un support sélectif et fabriqués via une procédure complète en cabinet avec une imprimante 3D de bureau.
2.Matériaux et méthodes
-
Critères d’inclusion et d’exclusion
Au cours d’une période de deux ans, tous les patients partiellement édentés ont été aiguillés vers un cabinet de dentistes privé pour une restauration au moyen d’implants dentaires. Les critères d’inclusion étaient les suivants : patients ayant une ou deux dents adjacentes manquantes dans les deux arcades (maxillaire et/ou mandibule); os suffisant pour placer des implants d’au moins 3,3 mm de diamètre et de 8,0 mm de longueur; et disposition du patient à participer pleinement au protocole. Les critères d’exclusion étaient les suivants : les patients atteints de maladies systémiques (p. ex., diabète non contrôlé, maladies sanguines et maladies psychiatriques) qui pourraient représenter une contre-indication à la chirurgie implantaire; les patients subissant une chimiothérapie et/ou une radiothérapie pour le cancer de la région de la tête et du cou; patients recevant des traitements immunosuppresseurs; les patients traités avec des bisphosphonates (par voie parentérale et/ou orale); les patients ayant des infections parodontales actives (pus, fistules et abcès parodontaux); les patients atteints d’autres maladies buccodentaires (maladies vésiculolobulaires et ulcéreuses, lésions rouges et blanches, maladies des glandes salivaires et lésions kystiques); les patients ayant une mauvaise hygiène buccodentaire et les patients ayant des limitations fonctionnelles ou des troubles temporomandibulaires.
Tous les patients ont été pleinement informés du protocole de la présente étude et ont signé un formulaire de consentement éclairé détaillé avant d’être inscrits. L’étude a été menée conformément aux principes énoncés dans la Déclaration d’Helsinki sur l’expérimentation sur des sujets humains et a été approuvée par le Comité local d’éthique de l’Université d’Insubria.
-
Acquisition des données
Chacun des patients sélectionnés pour la présente étude prospective a été soumis à un balayage intrabuccal des arcades, avec un puissant scanner à lumière structurée. (CS 3600®, Carestream Dental, Atlanta, GA, USA)
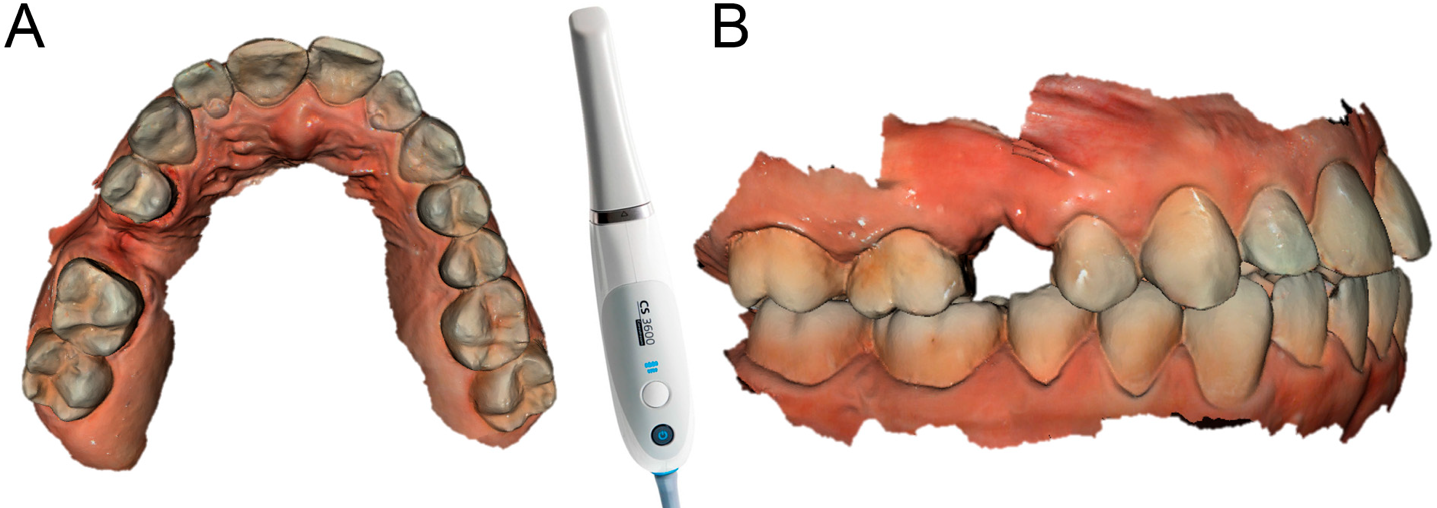
Figure 1. Acquisition intrabuccale CS 3600® (Carestream Dental, Atlanta, Géorgie, États-Unis). La deuxième prémolaire droite (#15) est manquante et un implant va être planifié. (A) Vue occlusale. (B) Vue latérale.
Ce balayage a été effectué en mode orthodontique et consistait en un balayage du modèle principal (site de l’œntulisme), de l’antagoniste et de la capture de la morsure (occlusion). Au cours de l’examen, l’opérateur a pris soin de capturer tous les détails morphologiques des dents adjacentes à l’implant, c’est-à-dire celles sélectionnées pour soutenir le futur guide chirurgical. Dans le même temps, une attention particulière a été accordée à l’acquisition de tissus mous dans le domaine de l’œntulisme. Les fichiers ainsi acquis ont été enregistrés en format STL dans un dossier spécial. Au cours de la même session, le patient a ensuite été soumis à un examen radiologique 3D avec tomodensitométrie à faisceau conique (CBCT), à l’aide d’un scanner puissant avec champ de vision réglable (CS 9300®, Carestream Dental, Atlanta, GA, USA)
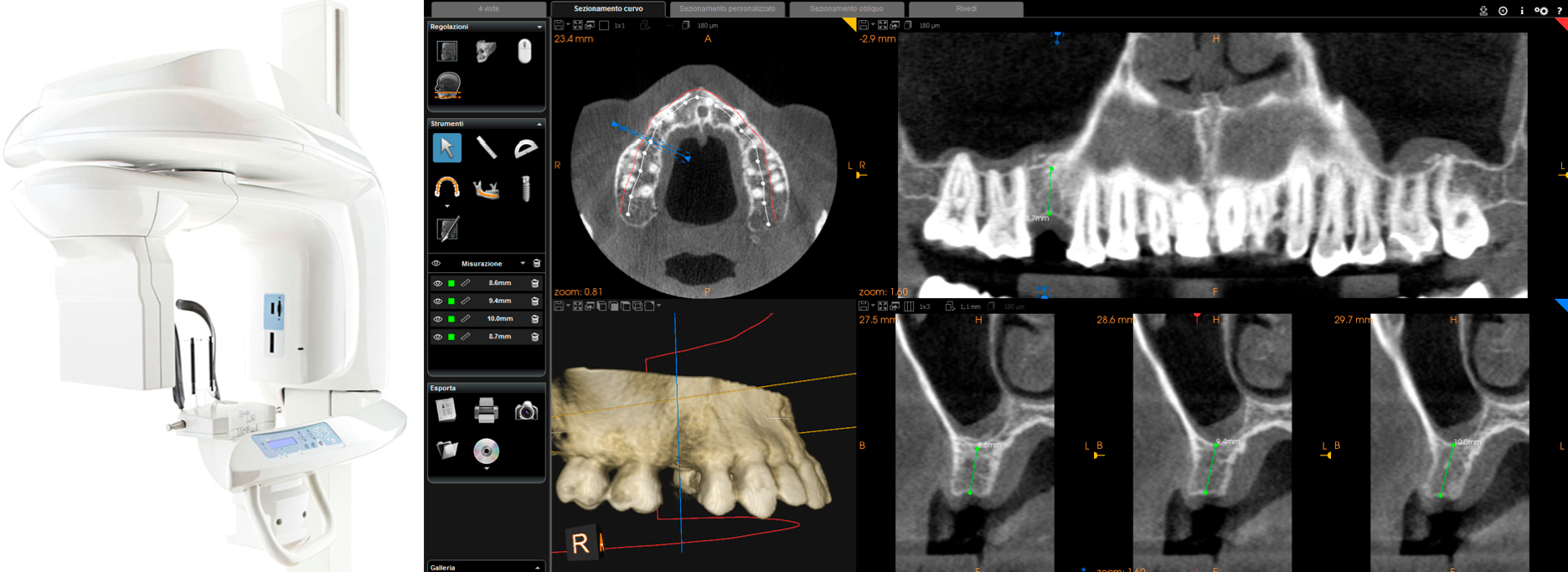
Figure 2. CBCT avec CS 9300® (Carestream Dental, Atlanta, Géorgie, États-Unis). La première visualisation du CBCT révèle un volume osseux suffisant (hauteur et largeur) pour planifier la position d’un implant dentaire.
L’opérateur a donc pu sélectionner le champ de vision (FOV) le plus approprié pour le cas (habituellement un FOV de 10x5 cm, pour faciliter le chevauchement avec le modèle dérivé de l’acquisition intrabuccale, en présence d’artefacts métalliques, mais dans certains cas sans artefacts, même un FOV de 5x5 cm) et ensuite capturer l’anatomie osseuse 3D du patient, qui a été immédiatement affiché dans le logiciel de reconstruction CBCT. Avant l’examen radiologique, une attention particulière a été portée au centrage de la zone d’intérêt, à l’aide d’outils spécifiques dédiés ; ensuite, une grande attention a été portée pendant l’acquisition, de sorte que le patient n’a fait aucun mouvement et était complètement immobile. Après une première visualisation rapide du site d’intérêt, et une première mesure rapide de la hauteur et de l’épaisseur de la crête résiduelle, confirmant la faisabilité du cas, l’imagerie numérique et la communication dans les médicaments (DICOM) les fichiers dérivés du CBCT ont été enregistrés dans un dossier spécifique et étaient prêts à être importés dans le logiciel de chirurgie guidée.
-
Planning
La planification de l’affaire impliquait l’utilisation de deux logiciels différents : une prothèse CAO (EXOCAD®, Darmstad, Allemagne) pour la cire virtuelle et une CAO chirurgicale (SMOP®, Swissmeda, Baar, Suisse) pour la planification 3D du placement de l’implant et la conception du modèle chirurgical.
Dans l’ordre, les fichiers STL issus de l’examen intrabuccal ont été importés dans la prothèse CAO, où l’épilation virtuelle de la restauration (simple couronne ou prothèse fixe partielle) a été effectuée, en tenant compte des volumes, les formes et les contacts interproximaux des dents adjacentes et occlusales avec l’arc antagoniste. Le fichier de l’épilation à la cire a donc été enregistré dans un dossier spécial, toujours sous la forme STL, afin d’être ouvert dans la CAO chirurgicale avant de planifier le placement de l’implant. À ce stade, l’opérateur a ouvert le logiciel de CAD chirurgicale en important les fichiers DICOM dérivés de la CBCT du patient. Le logiciel présentait les différents plans de reconstruction (axial, coronal et sagittal) et permettait l’importation du fichier d’acquisition intrabuccale (.STL) qui était superposé à la reconstruction osseuse à partir de CBCT. La superposition a été effectuée avec soin, d’abord pour les points, puis pour les surfaces, et contrôlée dans chaque section. Cette phase était la plus délicate de toutes, car une erreur de chevauchement possible peut compromettre la planification et donc le positionnement de l’appareil dans la position exacte désirée. Une fois que la qualité du chevauchement entre l’acquisition intrabuccale et la reconstruction osseuse par CBCT a été soigneusement vérifiée, l’opérateur a identifié les structures anatomiques à risque (nerf inférieur alvéolaire, sinus maxillaire) et la conception de la courbe panoramique, afin d’obtenir les sections désirées. L’opérateur a importé le fichier STL du modèle en cire diagnostique et a procédé à la planification d’un implant d’une longueur et d’un diamètre appropriés au site receveur, en tenant compte de l’anatomie osseuse résiduelle et des informations importantes dérivées du modèle en cire. L’implant a donc été planifié dans la meilleure position possible et guidé prothétiquement par rapport à l’anatomie osseuse résiduelle. Une attention particulière a été portée à la position et à l’inclinaison de l’appareil et à sa compatibilité avec l’apparition de la prothèse. Dans le cas de patients nécessitant un traitement avec plus d’un implant, les mêmes opérations ont été répétées pour chacun des appareils sélectionnés. A ce stade, les instruments paramétriques ont permis au clinicien d’établir la distance entre la gaine et l’épaule de l’implant, en fonction de la hauteur de la gencive disponible : En accord, à partir de la longueur de l’implant sélectionné, et à partir de la hauteur de la gaine (5 mm dans la présente étude) dérivé les données relatives à la profondeur de forage, un élément clé dans la phase chirurgicale. En outre, les outils paramétriques du logiciel ont permis d’ajuster la largeur du diamètre extérieur du trou dans le gabarit, pour l’insertion et la fixation du manchon.
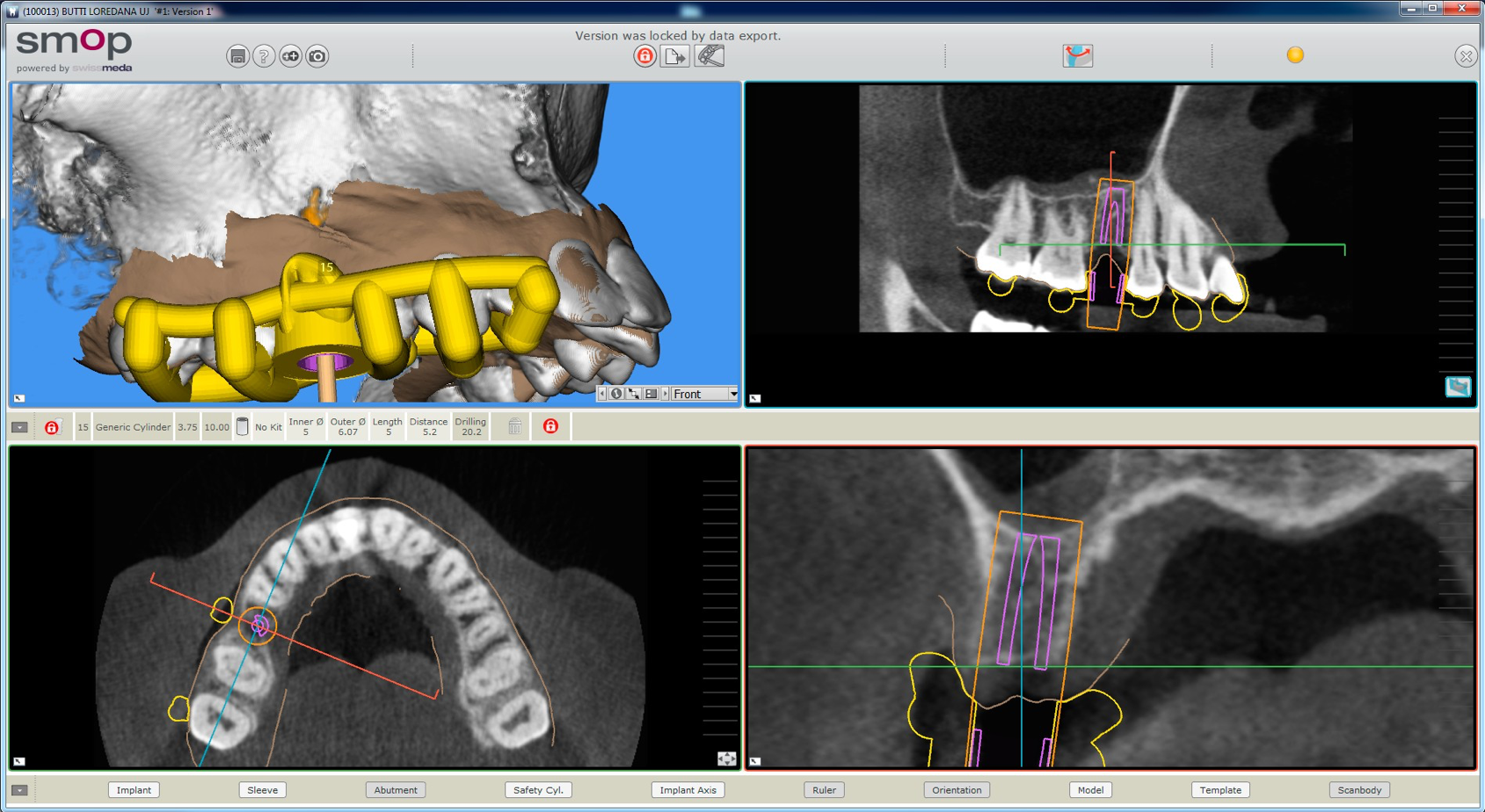
Figure 3. L’implant est prévu à l’aide d’un logiciel de chirurgie guidée (SMOP®, Swissmeda, Baar, Suisse). Un implant de 3,75x10 mm (BT Safe Bone Level®, BTK, Dueville, Italie) est donc prévu.
Comme, dans cette étude, les manchons utilisés étaient caractéristiques d’un diamètre extérieur de 6 mm, un certain degré de tolérance a été établi (0,07 mm) de sorte que le diamètre de ce trou a été fixé à 6,07 mm. Après avoir réglé ces éléments clés, la position des implants a été bloquée et l’opérateur a opté pour le modèle chirurgical. Quelques simples opérateurs de CAO ont permis au chirurgien de dessiner un guide chirurgical sélectif à dents ouvertes. Le support était basé sur des pinces buccales et palatines (linguales) et des supports occlusaux sélectifs. Le chirurgien était libre à ce stade de réguler le degré de décollement des pinces, et leur taille, ainsi que les dimensions et les caractéristiques des supports occlusaux et muqueux. Cette phase de conception a été réalisée d’une manière simple mais paramétrique, permettant au chirurgien d’avoir un contrôle dimensionnel total des composants et des formes dessinées. La particularité de ces modèles chirurgicaux a été démontrée par le fait qu’ils étaient ouverts, avec des supports sélectifs sur les surfaces dentaires, contrôlables en section, pour une vérification parfaite de l’adaptation sur des modèles imprimés en 3D et un contrôle intrabuccal constant pendant la chirurgie. À la fin de ce processus, le logiciel a calculé un guide chirurgical qui a été facilement exporté sous forme de fichier STL, moyennant le paiement d’une taxe à l’exportation (à prix variable, par rapport au nombre de cas prévus et d’exportations demandées).
-
Impression 3D des modèles et des modèles chirurgicaux
Après avoir modélisé et enregistré les modèles chirurgicaux, le clinicien a prévu l’impression de modèles 3D dérivés de la numérisation intrabuccale, et des mêmes modèles chirurgicaux, avec une imprimante de bureau stéréolithographique (SLA) puissante (XFAB2000®, DWS, Thiene, Vicenza).

Figure 4. Les modèles sont imprimés en résine (Invicta917®) avec une imprimante 3D stéréolithographique de bureau (SLA) (XFAB2000®, DWS, Thiene, Italie). (A) Vue occlusale. (B) Vue latérale.
Figure 5. Le gabarit chirurgical sélectif ouvert est imprimé avec l’imprimante XFAB2000 SLA (XFAB2000®, DWS, Thiene, Italie) à l’aide de la résine DS3000®.
En particulier, deux résines différentes ont été utilisées : l’anthracite Invicta917® (gris) pour la production des modèles physiques des arcades dentaires du patient et le DS3000® (transparent) pour la production des gabarits chirurgicaux. Pour l’impression des modèles, les fichiers STL ont été importés dans un logiciel de planification d’impression 3D (Nauta®, DWS, Thiene, Vicenza) et placés sur la plaque d’impression. Dans ce logiciel les broches et le support pour l’impression 3D ont été insérés, avec des caractéristiques paramétriques définies, et une base a été introduite pour une meilleure stabilisation du modèle pendant l’impression. Un soin à été apporté afin d’éviter que les broches et les supports soient positionnés au niveau de la table occlusale des modèles (et notamment au niveau des points d’appui du guide chirurgical, qui devaient rester libres) ou, pire encore, à la surface interne (support) des modèles chirurgicaux. Une fois l’impression 3D planifiée, les modèles et les guides chirurgicaux ont pu être reproduits phisiquement grâce au logiciel de gestion d’imprimante 3D (Fictor®, DWS, Thiene, Vicenza). Dans ce logiciel, il était possible de décider du matériau avec lequel imprimer les modèles et les modèles chirurgicaux (les matériaux étaient fournis dans différents plateaux interchangeables) et de contrôler la fonctionnalité de l’imprimante d’une manière simple et intuitive. À la fin de chaque processus d’impression, le produit final (modèle denté ou modèle chirurgical) a ensuite été rincé à fond dans deux bains d’alcool éthylique, pendant 10 minutes chacun; par conséquent, les manchons ont été positionnés et bloqués à l’intérieur des modèles chirurgicaux pour une utilisation clinique. Les modèles chirurgicaux ont ensuite été ajustés manuellement sur des modèles imprimés en 3D, en prenant soin d’éliminer les fentes excessives et d’obtenir un ajustement absolument stable. Cette adaptation a eu lieu en ajustant les gabarits chirurgicaux de 8 à 10 fois sur les modèles à dents correspondants. À la fin de cette procédure, les clichés chirurgicaux ont été stérilisés et étaient prêts à être utilisés en chirurgie.
-
Chirurgie
Le patient s’est assis sur la chaise dentaire et a rincé 3 ou 4 fois avec de la chlorexidine 0,2% rince-bouche, 10 min avant la chirurgie, pour un total de 2 min.
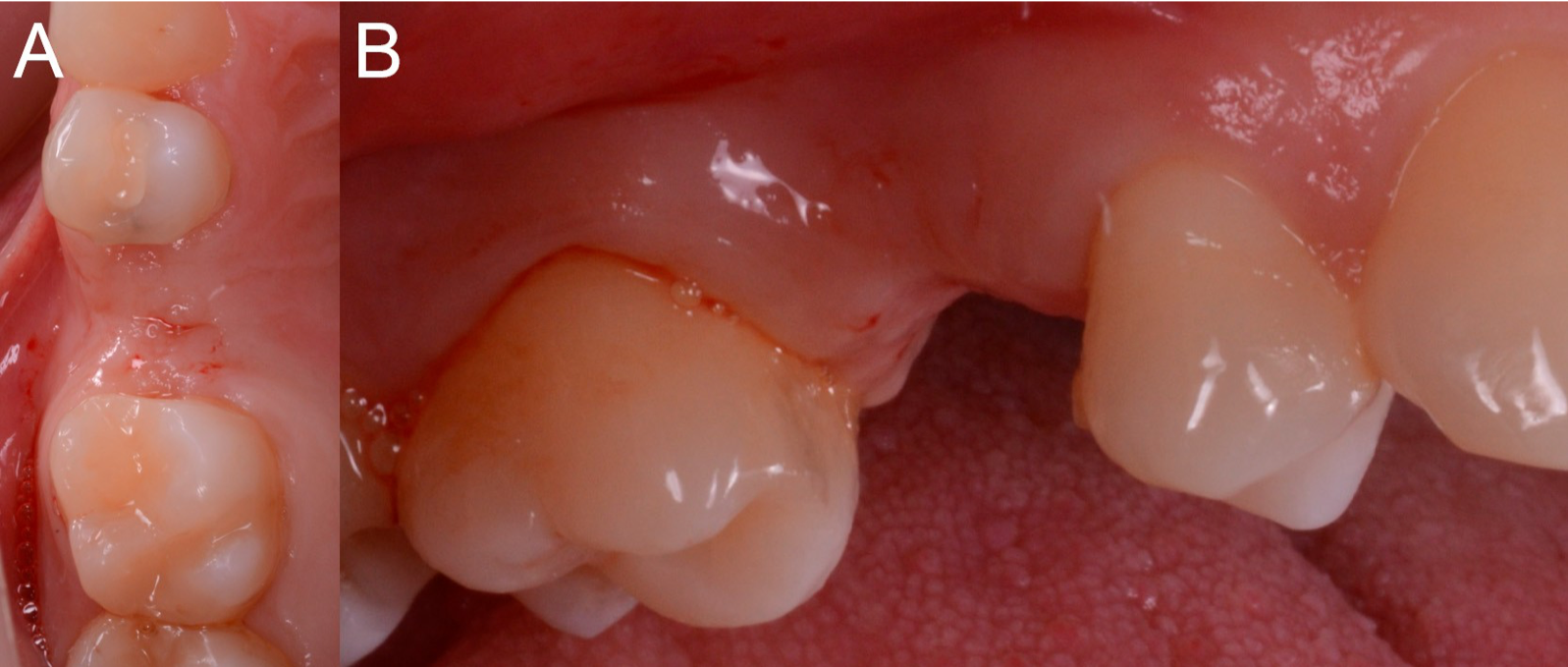
Figure 6. Situation préopératoire. (A) Vue occlusale. (B) Vue latérale.
Après une anesthésie locale par infiltration avec de l’articaïne avec de l’adrénaline (à un rapport de 1:100000), le chirurgien positionne le guide chirurgical sur support dentaire, en vérifiant sa stabilité et son adaptation exacte sur les surfaces occlusales des dents.
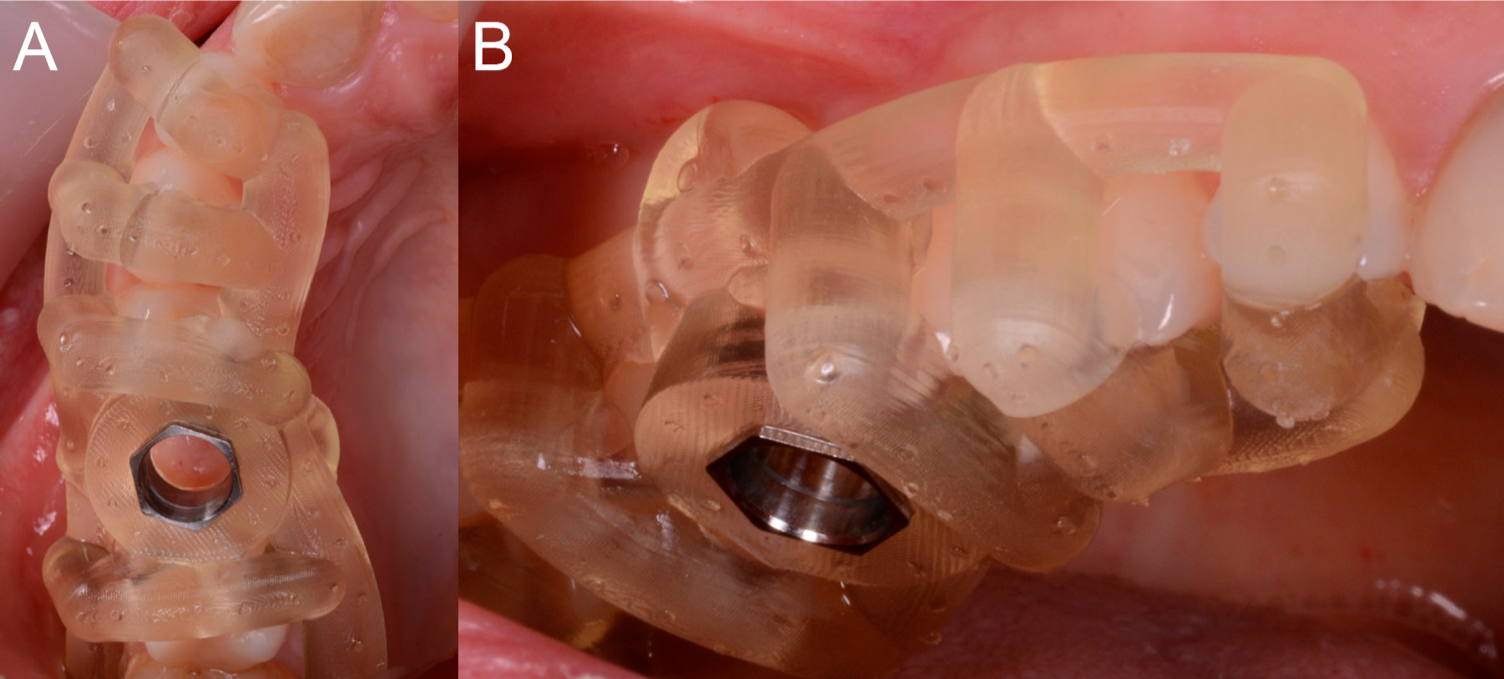
Figure 7. Le guide chirurgical en position avec le manchon inséré dans. (A) Vue occlusale. (B) Vue latérale.
Cette vérification a été possible grâce à la conception du guide chirurgical, qui était ouvert et a ainsi permis au chirurgien de vérifier directement l’ajustement parfait du gabarit sur les surfaces occlusales des dents. Une fois l’adaptation du gabarit vérifiée, selon le plan chirurgical, le chirurgien a réalisé la mucotomie, avec une muqueuse dédiée, à travers le guide chirurgical, afin d’enlever la quantité nécessaire de gingiva et de créer un accès pour la préparation du site implantaire. Une fois la mucotomie terminée, le chirurgien a commencé à préparer le site de l’implant, conformément au plan chirurgical (et donc à la profondeur de forage préétablie) et en accord avec le diamètre et la longueur de l’implant choisi.
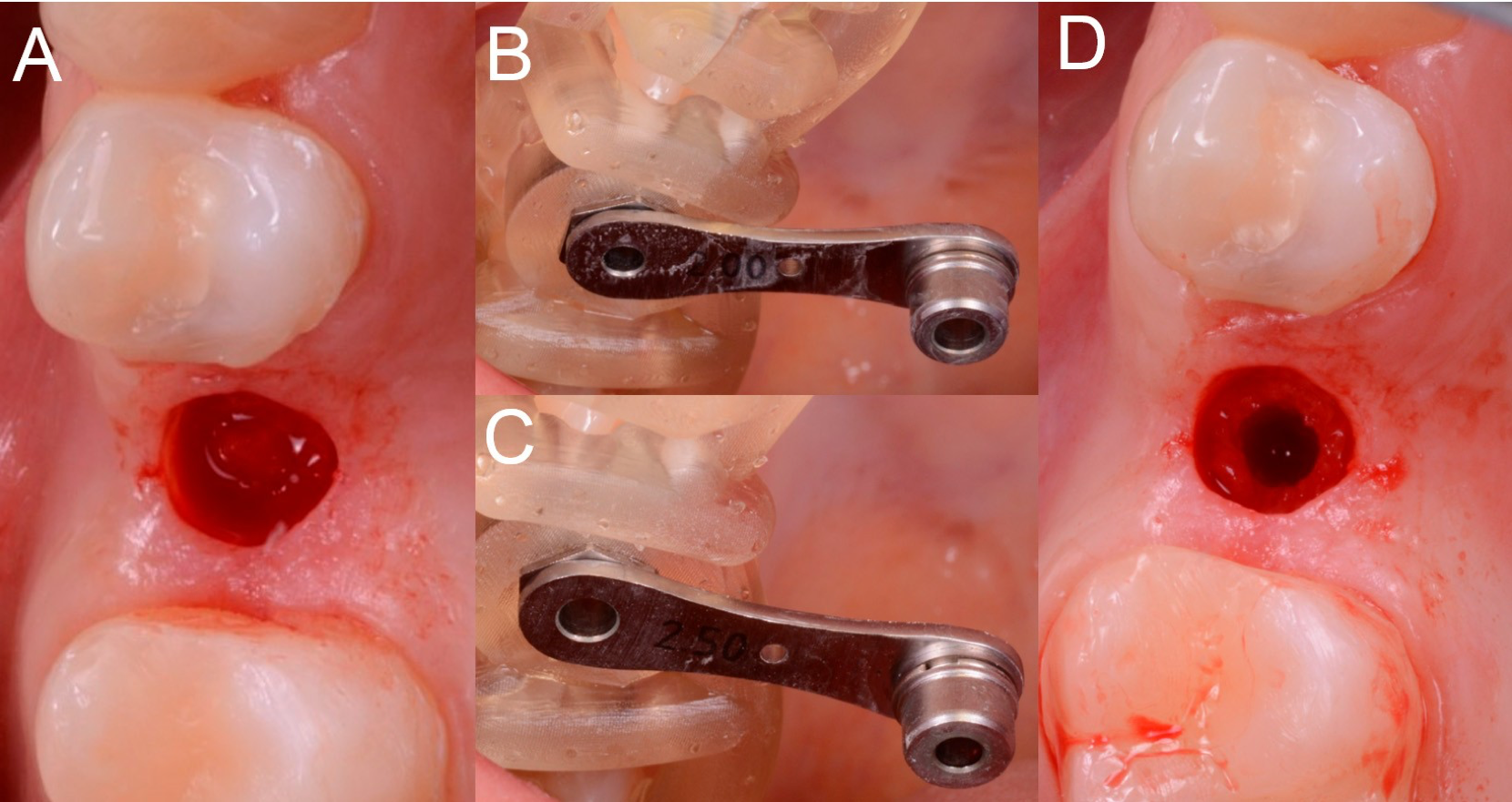
Figure 8. Différentes phases de la chirurgie. (A) Mucotomie; (B,C) Préparation du lit implantaire avec différents réducteurs insérés dans la gaine. (D) Vue occlusale pendant la préparation du lit de l’implant.
Les implants utilisés dans le cadre de cette étude étaient des implants coniques à filetage agressif (BT Safe Bone Level®, BTK, Dueville, Vicenza, Italie), disponibles en différents diamètres (3,3 - 3,75 - 4,1 et 4,8 mm, respectivement) et longueurs (6, 8, 10, 12 et 14 mm, respectivement). La préparation du site chirurgical était la suivante. Une fois l’opercule muqueux ouvert, le chirurgien a pris le drill pilote (2,0 mm) et monté sur celui-ci l’arrêt choisi, selon le plan chirurgical (arrêt en profondeur, pour pouvoir forer exactement à la profondeur désirée). Une fois cette opération terminée, le chirurgien monte le réducteur du diamètre correspondant à la perceuse (2,0 mm) à l’intérieur du manchon. À ce stade, le chirurgien a foré jusqu’à l’arrêt, c’est-à-dire en amenant l’arrêt de la foreuse en contact avec l’épaule de la manche, sous l’irrigation abondante de solution saline. Les mêmes opérations ont été répétées pour les différentes foreuses à diamètre incrémental. En fait, le chirurgien a retiré le réducteur de 2,0 mm et l’a remplacé, dans le manchon, par un réducteur de 2,5 mm. La perceuse de 2,5 mm a été montée sur la pièce à main avec la butée de profondeur utilisée précédemment et le chirurgien a foré jusqu’à la butée. Ces étapes ont été répétées jusqu’à ce que le site de l’implant soit préparé au diamètre désiré, par le passage de forets de diamètre incrémental (3,1- 3,45 - 3,75 et 4,35 mm). En particulier, pour pouvoir positionner un implant de 3,3 mm de diamètre, la dernière perceuse avait un diamètre de 3,1 mm; pour pouvoir placer un implant de 3,7 mm, la dernière perceuse avait un diamètre de 3,45 mm; pour pouvoir positionner un implant de 4,1 mm, la dernière perceuse avait un diamètre de 3,75 mm; enfin, pour placer un implant de 4,8 mm, la dernière perceuse avait un diamètre de 4,35 mm. Une fois le lit d’implant préparé, le chirurgien a sélectionné l’appareil du diamètre et de la longueur désirés et l’a inséré dans le guide chirurgical, puis dans la gaine (sans réducteur).
L’implant a d’abord été inséré dans la pièce à main, avec un couple d’insertion maximal de 30 Ncm; dépassant ce seuil, le chirurgien a procédé manuellement pour un meilleur contrôle. À la fin de l’insertion, le chirurgien a retiré le gabarit et vérifié l’axe de l’implant à l’aide d’un instrument dédié, puis a placé une vis de guérison transmucosale d’une hauteur telle qu’elle ne devait pas être couverte par la muqueuse pendant la phase de guérison.
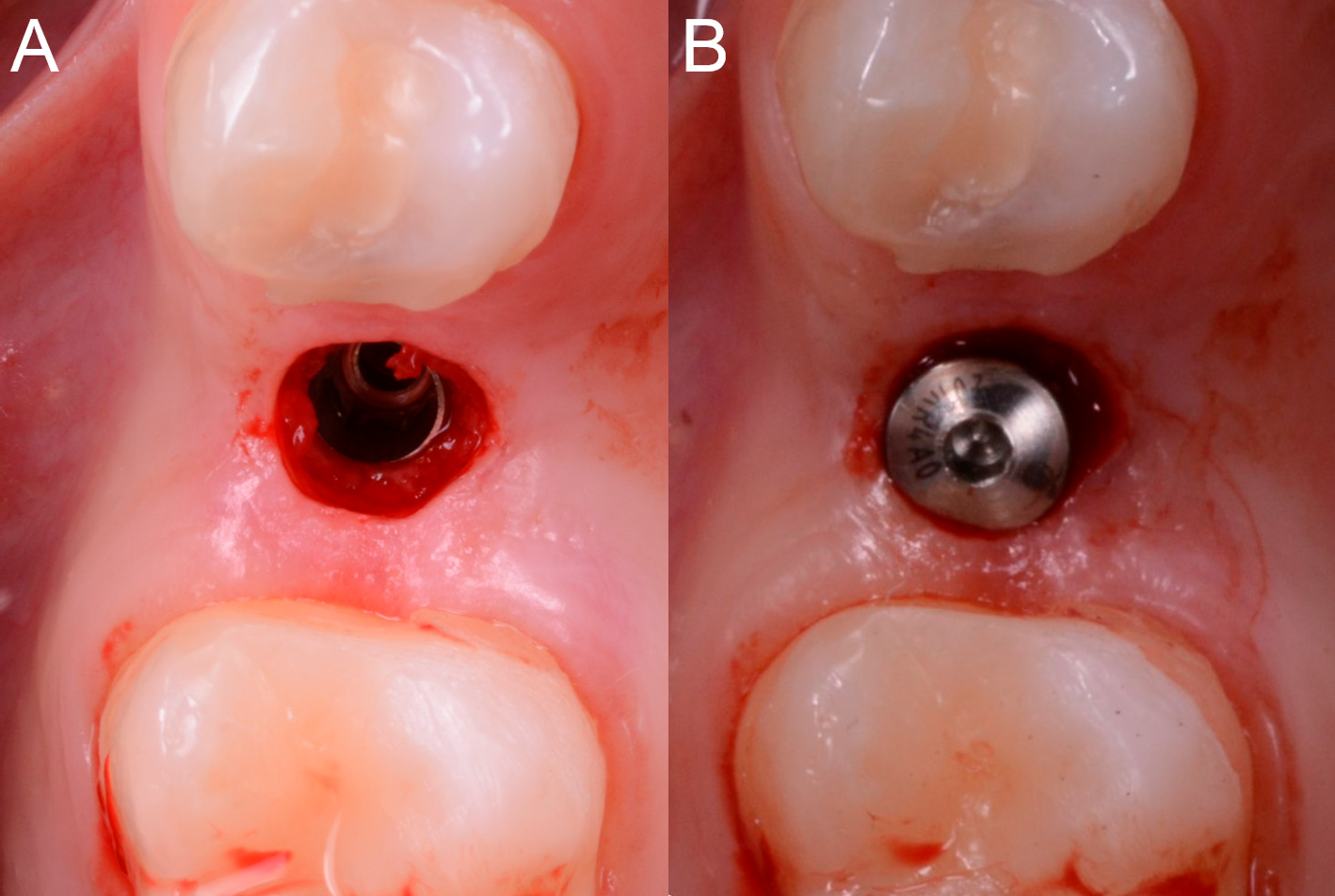
Figure 9. Positionnement de l’implant. (A) L’implant (BT Safe Bone Level, BTK, Dueville, Italie) est inséré dans le guide, dans la position, l’inclinaison et la profondeur prévues ; (B) Le pilier de guérison est positionné.
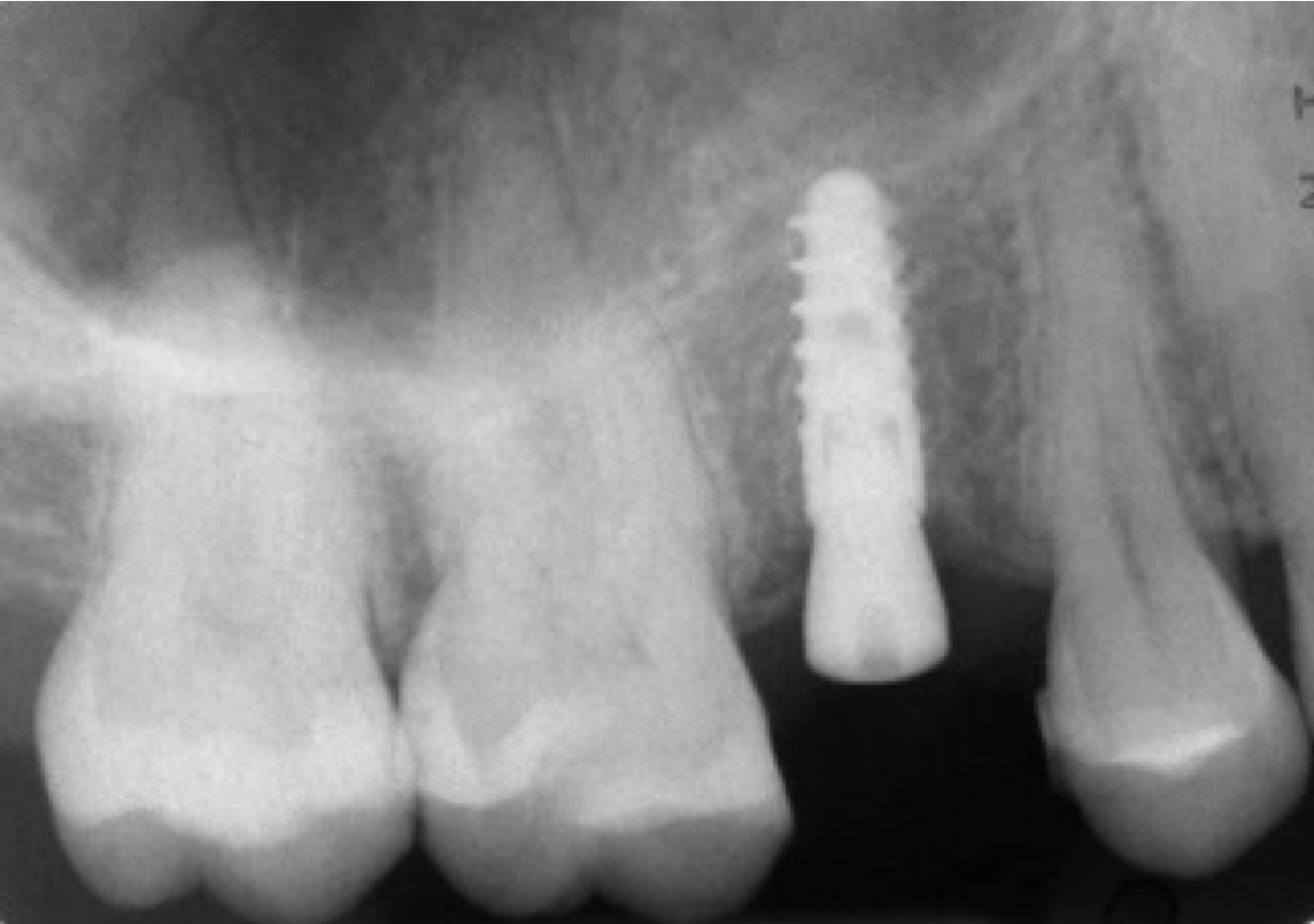
Figure 10. Contrôle de l’implant et du pilier de guérison après l’intervention chirurgicale.
L’opération a été terminée et le patient a été laissé à la maison avec l’indication d’effectuer 3 ou 4 bains de bouche avec de la chlorexidine 0,2% dans les 4 jours suivant l’opération, et avec une prescription d’analgésique à prendre au besoin (ibuprofène 600 mg, maximum 2/jour). Comme aucune suture n’a été placée, la première visite de suivi a été fixée à 10 jours après l’intervention.
-
Prothèse
Les phases prothétiques ont commencé avec le retrait du pilier de guérison transmucosale, 2 mois après le placement de l’implant, et une impression optique avec un scanner intrabuccal (CS 3600®, Carestream Dental, Atlanta, GA, USA) après le positionnement du corps d’acquisition.
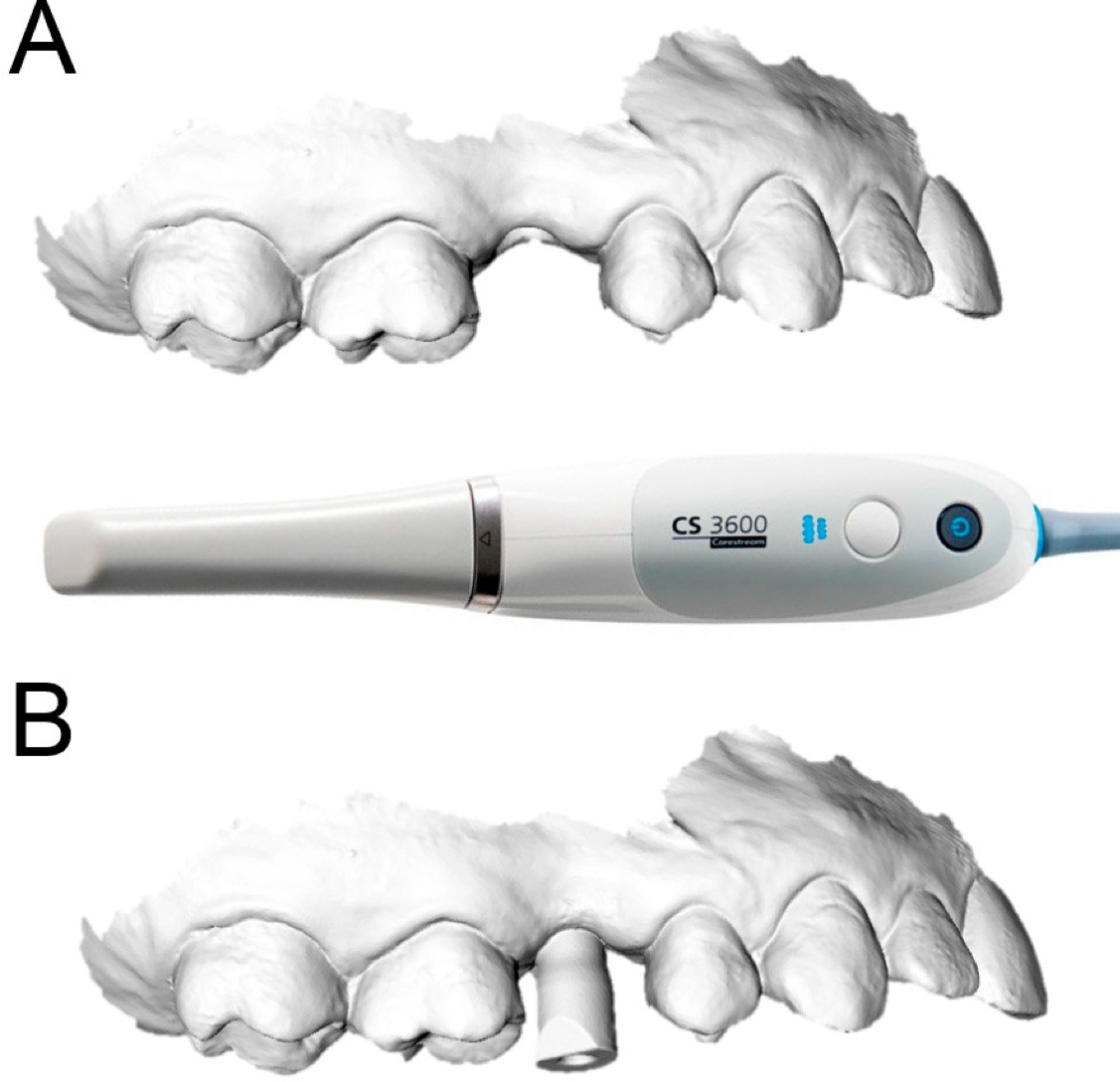
Figure 11. Impression optique avec CS 3600® (Carestream Dental, Atlanta, Géorgie, États-Unis). (A) Sans scanbody. (B) Avec le corps d'acquisition.
Le balayage se limitait au secteur d’intérêt, y compris l’arc antagoniste. L’impression (fichier .STL ou .PLY) a ensuite été envoyée au technicien dentaire, qui a procédé à la conception de la restauration prothétique provisoire du polyméthacrylate de méthyle (PMMA) et du pilier de zirconium personnalisé dans le logiciel de conception assistée par ordinateur (CAO). (DentalCAD®, Exocad, Darmstadt, Allemagne).
Le pilier personnalisé a été conçu pour être cimenté sur un pilier en titane (BT link® BTK, Dueville, Vicenza, Italie), vissé sur l’implant. Le pilier personnalisé a été usiné en zircone avec une fraiseuse 5 axes puissante (DWX-50®, Roland, Ascoli Piceno, Italie), fritté dans un four (Tabeo®, Mihm-Vogt, Stutensee, Allemagne) et cimenté extra-oralement sur la base de titane. Toutefois, la couronne provisoire a été obtenue par fraisage de PMMA avec une fraiseuse à 4 axes (DWX-4®, Roland, Ascoli Piceno, Italie). Après la cimentation extra-orale, le pilier hybride individuel (titane/zircone) a été positionné et vissé sur l’implant. La restauration provisoire du PMMA a finalement été cimentée avec un ciment d’eugénol à l’oxyde de zinc (TempBond®, Kerr, Orange, CA, USA).
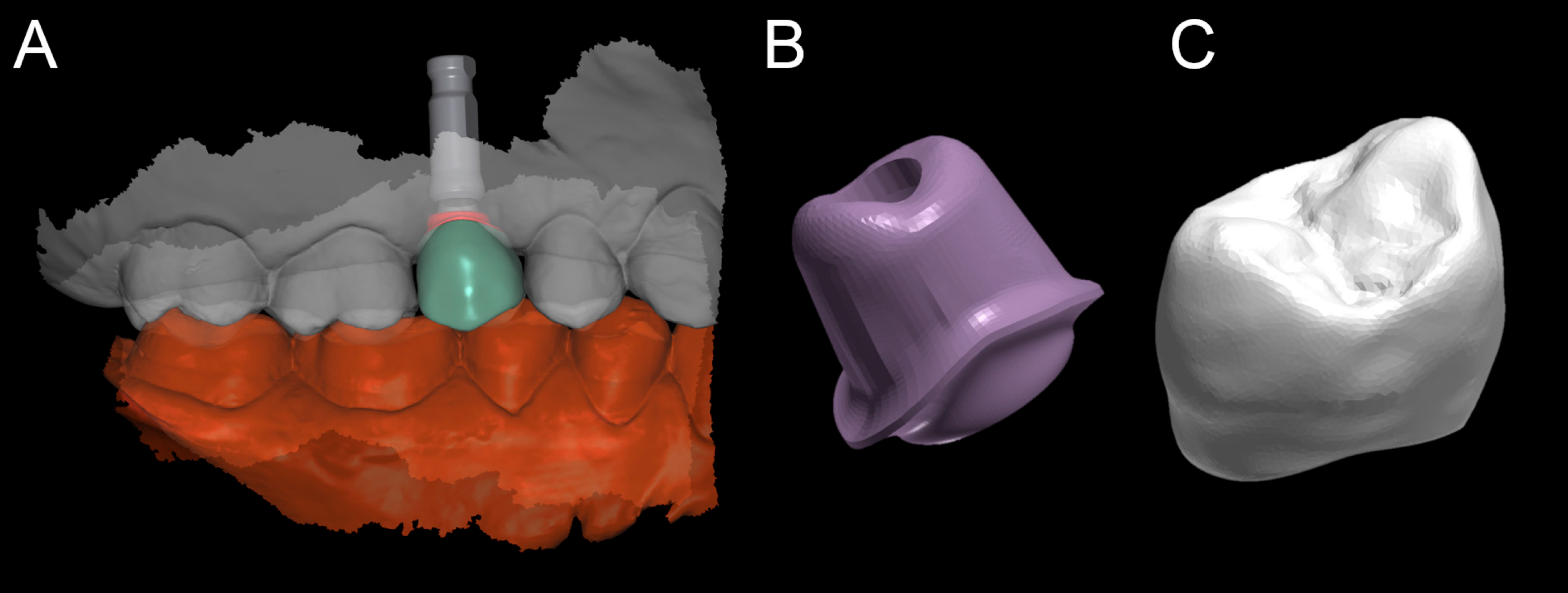
Figure 12. Projet de conception assistée par ordinateur (EXOCAD®, Darmstadt, Allemagne). (A) Scène CAO. (B) Détails du pilier en zircone individuel (partie supérieure du pilier hybride) et de la couronne en PMMA (C).
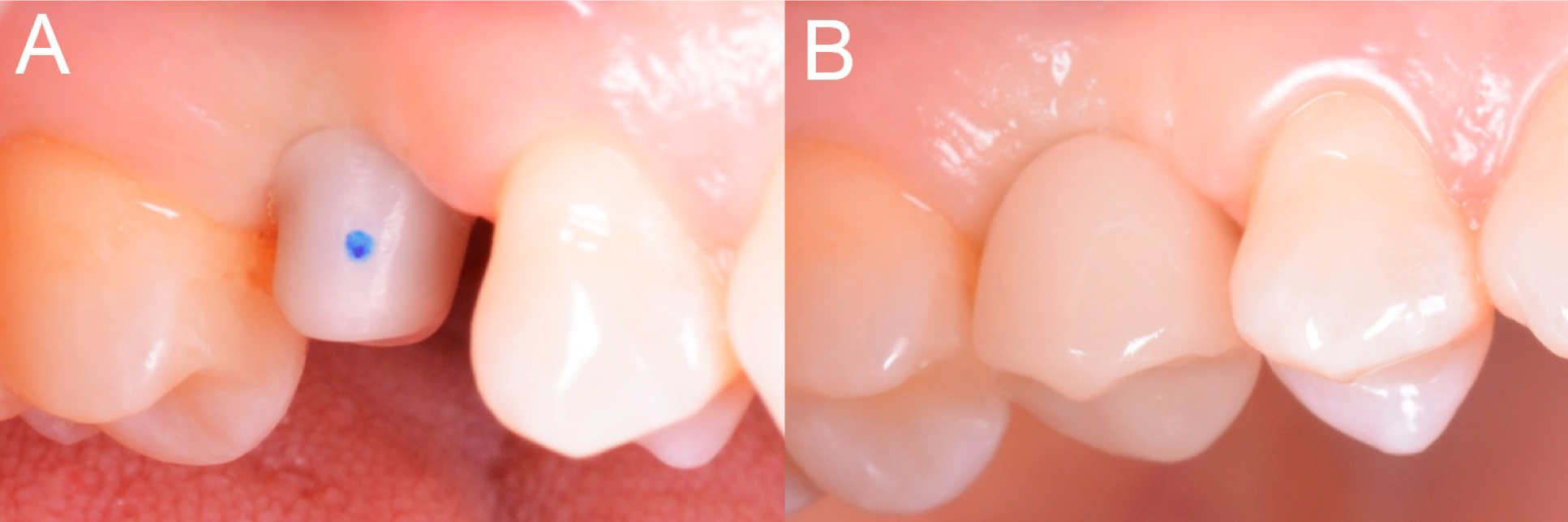
Figure 13. Livraison de la butée de zircone individuelle (A) et de la couronne provisoire de PMMA (B).
L’occlusion a été soigneusement vérifiée, puis le polissage et la coloration/caractérisation ont été effectués. Tous les précontacts occlusaux enregistrés au cours de cette phase avec des papiers articulés (Bausch Articulating Paper®, Bausch Inc, Nashua, NH, USA) ont été photographiés, afin de guider par la suite la modélisation de la restauration finale. Les provisions de PMMA ont été laissées en place pendant une période de 2 mois, après quoi elles ont été remplacées par des restaurations définitives de zircone monolithique. Dans tous les cas, la zircone translucide (Katana®, Kuraray Noritake, Tokyo, Japon) a été employée. La conception des restaurations finales a été obtenue en modifiant correctement la conception des dispositions dans la scène CAD précédente, sans avoir besoin d’autres impressions. On a pris soin d’adapter les espaces de ciment aux besoins du nouveau matériau (zircone) et de vérifier et modifier les points de contact occlusaux, sur la base des indications recueillies au moment du positionnement des provisions en PMMA. Les restaurations finales ont été cimentées avec du ciment d’eugénol à l’oxyde de zinc.
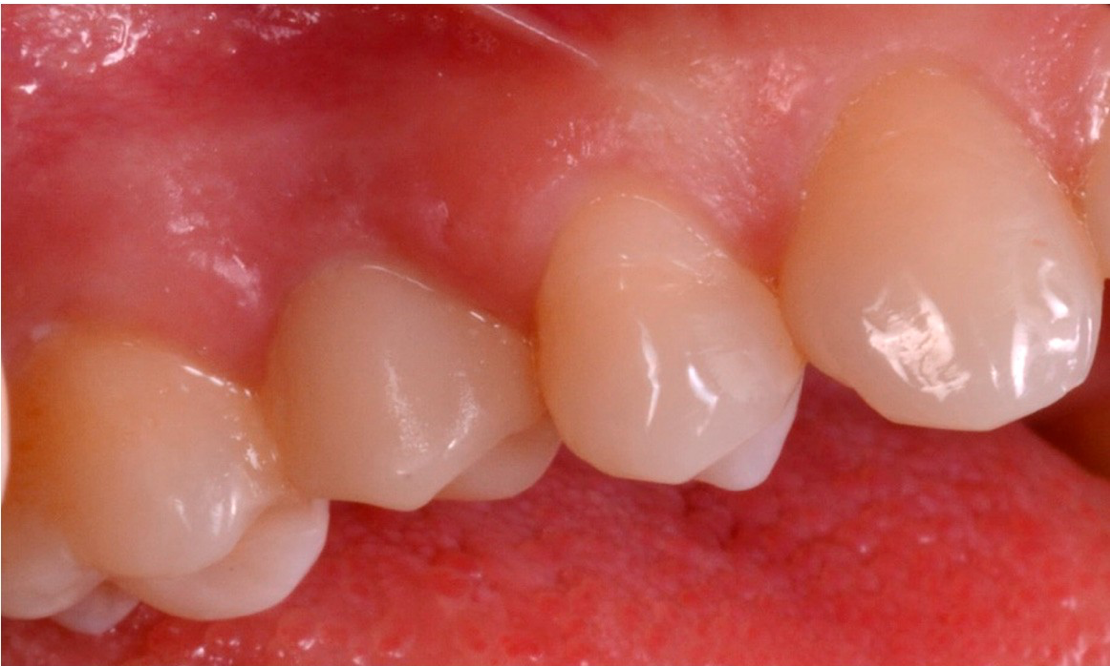
Figure 14. Livraison de la dernière restauration monolithique translucide en zircone.
Dans tous les cas, aucun modèle physique des mâchoires n’a été préparé.
-
Résultats de l’étude
Les patients ont été suivis pendant au moins un an après le placement de l’implant, avec au moins trois ou quatre visites de suivi annuelles après le placement de l’implant. Les résultats de l’étude étaient différents et recueillis à la fois directement au moment de la chirurgie (stabilité et adaptation des modèles chirurgicaux, moment de la chirurgie, complications peropératoires liées à l’intervention chirurgicale guidée, stabilité de l’implant), et après un certain temps, au cours des bilans annuels (complications biologiques et prothétiques) et à la fin de l’étude, c’est-à-dire au contrôle de suivi d’un an (survie des implants).
-
Ajustement et stabilité des gabarits chirurgicaux
L’ajustement et la stabilité des modèles chirurgicaux ont constitué les premiers résultats de la présente étude. L’ajustement et la stabilité des guides ont été cliniquement vérifiés par le chirurgien au moment de la chirurgie. L’ajustement ou l’adaptation du gabarit dépendait essentiellement de l’ajustement du guide sur les surfaces occlusales des dents de soutien et sur les surfaces approximatives des dents adjacentes. Pour cette raison, l’ajustement a d’abord été vérifié par une analyse visuelle minutieuse de l’adaptation du gabarit sur les surfaces occlusales des dents d’appui. Cette analyse a été rendue possible grâce à la conception particulière des gabarits chirurgicaux utilisés dans cette étude, qui a permis d’évaluer l’adaptation des supports occlusaux directement dans la section, et donc la correspondance exacte entre la conception du guide chirurgical et l’anatomie de la table occlusale. L’ajustement dépendait alors également de l’adaptation du gabarit sur les surfaces approximatives des dents adjacentes aux implants : Cette adaptation devait être parfaite et ne nécessitait pas d’autres interventions ou modifications pendant l’opération. Selon le protocole de l’étude, après avoir testé le guide chirurgical dans la bouche du patient, le chirurgien pourrait définir l’ajustement du modèle comme optimal, suffisant ou inadéquat. Dans un cas d’ajustement optimal, aucune retouche n’a été nécessaire et le guide chirurgical a été utilisé sans aucune modification, comme reçu après la stérilisation. En cas d’adaptation suffisante, le gabarit a nécessité quelques modifications mineures (comme le polissage d’une ou de plusieurs surfaces) pour être adapté au mieux et procéder à l’intervention. Ces adaptations devaient être minimes, car elles pouvaient potentiellement affecter la position, l’inclinaison et la profondeur de l’implant et ainsi générer un écart entre la planification et la position réelle de l’implant après la chirurgie. Dans ce cas, cependant, l’ajustement était inadéquat (et nécessitait des changements majeurs pour pouvoir utiliser le gabarit), le chirurgien pouvait décider d’éliminer le guide chirurgical et de procéder à une chirurgie classique, en soulevant un lambeau mucopériosté pleine épaisseur et en préparant manuellement (sans aucun guide) le site de l’implant. De même, la stabilité du guide chirurgical (qui dépendait non seulement de l’ajustement sur les surfaces occlusales des dents du pilier et sur les surfaces approximatives des dents adjacentes à l’implant, mais aussi sur les pinces rétentives positionnées au collet des dents du support) a fait l’objet d’une vérification clinique par le chirurgien au moment de l’intervention. Un gabarit était considéré stable s’il était équipé d’un ajustement parfait, et absolument immobile pendant toutes les phases de la chirurgie (insertion de réducteurs dans les manchons, perçage, etc.). Dans le cas d’une stabilité optimale, le gabarit offrait une certaine résistance à l’insertion, en faisant un snap qui lui permettait d’être parfaitement bloqué par les pinces, grâce à un minimum de rainure conçue pour stabiliser parfaitement l’assemblage. Si le gabarit présentait un léger mouvement d’oscillation/de mouvement, le chirurgien pouvait procéder, mais la stabilité du gabarit était définie comme suffisante. Dans un cas de stabilité insuffisante, avec un mouvement d’oscillation majeur, le chirurgien pourrait suspendre l’intervention et, comme expliqué ci-dessus, éliminer le guide chirurgical et procéder à la chirurgie classique, avec un rabat pleine épaisseur et une préparation manuelle (non guidée) du site implantaire. Dans tous les cas effectués, l’ajustement et la stabilité des modèles chirurgicaux ont été rapportés dans le dossier du patient.
-
Durée (temps) de la chirurgie
De l’anesthésie et de l’essai du gabarit au positionnement de la vis de guérison et au retrait du gabarit, l’assistant de la chaise a surveillé le temps exact pris par le chirurgien. Ce temps, mesuré en minutes, a été marqué sur le dossier du patient.
-
Complications peropératoires liées à l’intervention chirurgicale guidée
Toute complication rencontrée au cours de l’opération (non seulement un ajustement ou une instabilité insuffisants du modèle) a été marquée dans le dossier du patient et signalée dans le présent examen. Parmi les complications peropératoires liées à la procédure de chirurgie guidée étaient : Fracture du guide chirurgical ; ouverture insuffisante de la bouche par le patient, rendant impossible la préparation du site implantaire par le guide chirurgical ; et une insertion clairement erronée de l’implant (en termes de position, d’inclinaison et de profondeur) qui nécessitait l’ouverture d’un lambeau mucopériosté, le retrait de l’implant et une nouvelle préparation. L’invasion des structures anatomiques à risque (nerf alvéolaire inférieur et sinus maxillaire ; dents adjacentes) et la perforation des corticales osseuses buccales et palatines (linguales) ont représenté les complications les plus insidieuses liées aux erreurs (planification ou exécution) pendant l’intervention chirurgicale guidée, et ils ont été inclus dans le dossier du patient.
-
Stabilité clinique de l’implant
La stabilité de chaque accessoire a été vérifiée cliniquement en appliquant un couple inversé de 20 Ncm. La stabilité a été vérifiée trois fois : immédiatement après le placement, à la livraison de provisoire, et aux restaurations finales.
-
Complications post-opératoires
Les complications qui pouvaient survenir dans les deux semaines suivant l’opération ont été classées comme des complications postopératoires. Elles comprenaient la douleur, l’inconfort, l’exsudation et la suppuration, l’enflure et l’infection de l’implant.
-
Complications pendant le suivi
Toutes les complications qui pouvaient affecter les implants de la deuxième semaine de chirurgie jusqu’à la fin de l’étude, ainsi que toutes les complications prothétiques qui ont affecté les restaurations soutenues par l’implant, ont été notées dans le dossier du patient. Ces complications ont été divisées en complications biologiques et prothétiques. Les complications biologiques comprenaient la mucosite périimplantaire et la périimplantite. Parmi les complications prothétiques figuraient le desserrage des vis et/ou la fracture, ainsi que la fracture/restauration du pilier de zircone.
-
Survie des implants
Un implant était considéré comme « survivant » s’il fonctionnait toujours au dernier contrôle clinique. Inversement, un implant était considéré comme ayant « échoué » dans tous les cas où le clinicien a été forcé de retirer l’appareil en raison de : Manque d’osséointégration avec la mobilité de l’appareil, en l’absence d’infection; infection grave et/ou récurrente (périimplantite) perte osseuse marquée; perte osseuse progressive en l’absence d’infection, mais avec mobilisation de l’implant; et fracture de l’implant. Les défaillances pourraient être définies comme « précoces » si elles se sont produites avant la restauration de la prothèse; elles étaient définies comme « tardives » si elles se sont produites après le placement du pilier de la prothèse et la fonctionnalisation de l’implant avec la couronne provisoire.
-
Analyse statistique
Les données ont été recueillies par un opérateur indépendant qui n’a pas participé directement au placement des appareils. Des statistiques descriptives ont été effectuées pour les caractéristiques démographiques des patients (sexe, âge au moment de la chirurgie et habitude de fumer) et les caractéristiques des implants insérés (site, position, longueur, diamètre). Les distributions de fréquence absolue et relative ont été calculées pour les variables qualitatives (ajustement et stabilité des modèles chirurgicaux, stabilité et survie des implants, complications), tandis que les moyennes, les écarts-types, les médianes et les intervalles de confiance à 95 % (IC) ont été estimées pour des variables quantitatives (âge du patient à la chirurgie, durée/temps de la chirurgie). La stabilité de l’implant, la survie et l’incidence des complications ont été calculées au niveau du patient et au niveau de la restauration.
-
Résultats
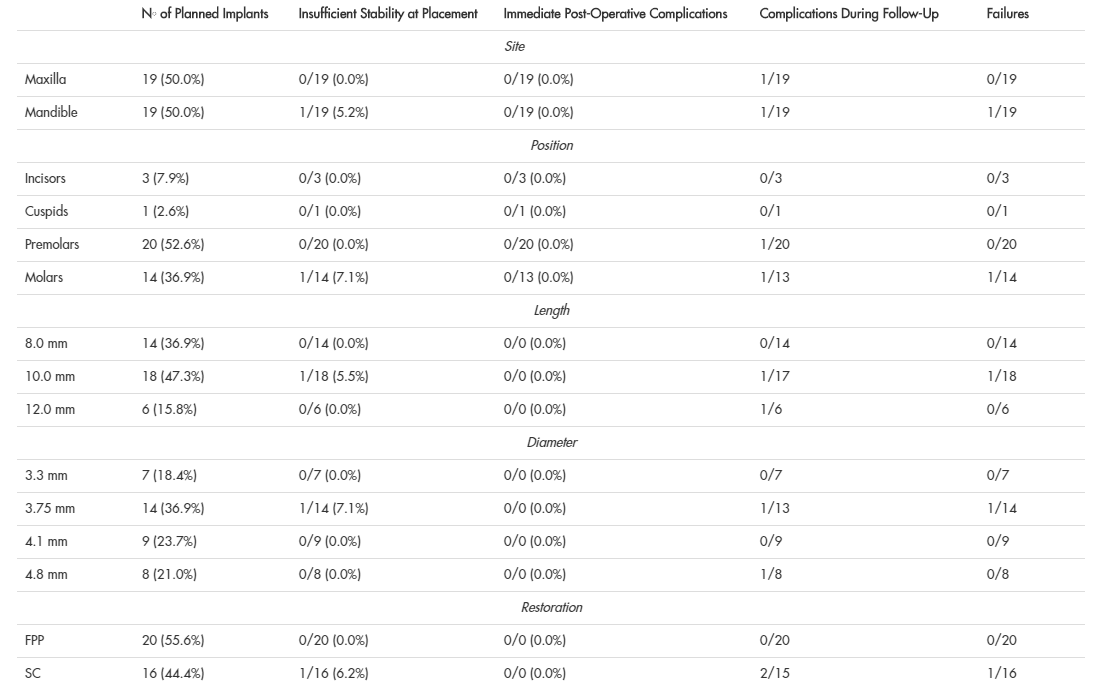
Au total, 20 patients partiellement édentés (9 hommes et 11 femmes, âge moyen 54,4 +/- 9,4 ans, intervalle de 39 à 67 ans, médiane 55,5 ans, intervalle de confiance 95 % 50,3 à 58,5 ans) ont été jugés admissibles à l’inscription à la présente étude clinique prospective. Au total, 28 modèles ouverts, sélectifs et soutenus par des dents ont été conçus dans le but d’insérer 38 implants hexagonaux internes (BT Safe bone level®, BTK, Povolaro di Dueville, Italie). Parmi les patients sélectionnés, seulement 4 (4/20 : 20 %) étaient fumeurs et 2 (2/20 : 10 %) étaient bruxistes. Parmi les implants prévus, 19 (19/38 : 50%) étaient maxillaires et 19 (19/38 : 50%) étaient mandibulaires; en particulier, trois des implants prévus (3/38 : 7,9%) étaient des incisives, un (1/38 : 2,6%) était un cuspide, 20 (20/38 : 52,6%) étaient des prémolaires, et 14 (14/38 : 36,9%) étaient des molaires. En ce qui concerne la longueur des appareils prévus, 14 (14/38 : 36,9%) étaient 8,0 mm de long, 18 (18/38 : 47,3%) étaient 10,0 mm, et six (6/38 : 15,8%) étaient 12,0 mm. Enfin, en ce qui concerne le diamètre de l’implant, sept (7/38 : 18,4 %) avaient un diamètre de 3,3 mm, 14 (14/38 : 36,9 %) 3,75 mm, neuf (9/38 : 23,7 %) 4,1 mm et huit (8/38 : 21,0 %) 4,8 mm.
Parmi les modèles chirurgicaux, 24 présentaient un ajustement et une stabilité optimaux, trois présentaient un ajustement optimal, mais seulement une stabilité suffisante, et un présentait un ajustement et une stabilité inadéquats et insatisfaisants. Dans le cas des modèles présentant un ajustement et une stabilité optimaux, le chirurgien a procédé à l’intervention, ainsi que dans les 3 cas où la stabilité était légèrement inférieure (seulement suffisante) et l’ajustement optimal. Dans ces derniers cas, cependant, le chirurgien a été aidé par l’assistant qui a gardé les modèles chirurgicaux dans la position correcte en exerçant une certaine pression avec deux doigts. Dans le cas où la stabilité et l’ajustement n’étaient pas satisfaisants, le chirurgien a soulevé un rabat de pleine épaisseur et a procédé au placement classique (et non guidé) de l’implant. La raison de cet échec dû à une adaptation imparfaite a été identifiée dans le long laps de temps écoulé entre la fabrication du gabarit et la chirurgie (plus d’un mois d’attente) avec la possibilité d’une déformation du gabarit en résine et de légers mouvements des dents de support.
En ce qui concerne le moment de la chirurgie, chez les 19 patients (27 modèles) réellement traités par chirurgie guidée, la durée moyenne de l’intervention (de l’anesthésie à la mise en place de la vis de guérison) était de 15,7 5,2 minutes par modèle (intervalle 8-25 min, médiane 15, intervalle de confiance 95 % 13,8-17,6) et 11,4 2,9 min par implant (plage de 7 à 18 min, médiane de 11 min, intervalle de confiance 95 % 10,5 à 12,3). Le temps moyen requis était légèrement plus élevé dans le cas d’une stabilité non optimale et seulement suffisante des clichés (13,6 1,5 min par implant).
Aucune complication peropératoire liée à la chirurgie guidée et à l’approche sans lambeaux n’a été rapportée dans la présente étude : par conséquent, aucun guide fracturé, aucune ouverture insuffisante du patient et aucune erreur majeure dans la position, l’inclinaison et la profondeur des implants n’étaient évidentes. Aucune structure à risque anatomique (nerf alvéolaire inférieur, sinus maxillaire) n’a été envahie et aucune perforation de l’os cortical n’a eu lieu.
Au moment du placement, la stabilité des 37 implants placés dans les guides avec une approche sans rabat était acceptable, sauf dans un cas (une première molaire mandibulaire chez une patiente âgée de 47 ans qui fume) où le site de réception n’était pas complètement guéri et l’appareil n’était pas stable. Ce dispositif a été retiré et le chirurgien a dû attendre quelques mois avant de procéder au placement de l’implant par une approche conventionnelle et non guidée. Aucun problème n’a été signalé quant à la stabilité de tous les 36 autres implants au cours du suivi complet de l’étude ou des contrôles subséquents (lors de la livraison des restaurations provisoires et finales).
Aucune complication postopératoire n’a été signalée après la chirurgie; en fait, tous les patients ont bénéficié du caractère invasif minimal de l’approche sans lambeaux et personne ne s’est plaint de douleur ou de gonflement dans les deux premières semaines suivant la chirurgie. Aucune exsudation, suppuration, enflure ou infection n’a été signalée. L’incidence de complications postopératoires immédiates était de 0% (0/36 implants).
Les 36 implants ont été restaurés avec succès avec 10 prothèses partielles fixes de deux unités et 16 couronnes simples.
Au cours de la période de suivi et de la mise à disposition, deux couronnes uniques ont subi une complication prothétique mineure, comme le desserrage des vis de butée. Cependant, les culées ont été vissées de nouveau sur les implants et aucune autre complication mécanique n’a été signalée pour ces appareils. À la fin de l’étude, l’incidence des complications était de 7,6 % (2 restaurations sur 26), mais ces complications étaient limitées à la période des provisions.
Un an après le placement, les 36 implants fonctionnaient régulièrement, pour un taux de survie de 100 % (36/36 implants survivent).
.png)
Figure 15. Contrôle de la prescription de suivi d’un an de la couronne portant l’implant.
-
Discussion
Ces dernières années, la révolution numérique a radicalement changé le monde de la dentisterie. En effet, des dispositifs puissants ont été introduits, tels que les scanners intrabuccaux, capables d’acquérir une empreinte dentaire extrêmement précise avec l’utilisation de la lumière, et la tomodensitométrie à faisceau conique (CBCT), grâce à laquelle le clinicien peut disposer de trois dimensions précises (3D) informations sur la hauteur et l’épaisseur de la crête osseuse résiduelle du patient, avec une faible dose de rayonnement. Ces machines, associées au logiciel de CAO chirurgical et prothétique, permettent au clinicien de travailler de manière prévisible, dans un flux de travail entièrement numérique.
Le domaine d’application idéal pour ces technologies semble être l’implantologie. En fait, grâce aux scanners CBCT et intrabuccaux, il est désormais possible d’acquérir des informations précises sur l’anatomie des os, des dents et des tissus mous ; en combinant ces informations dans un environnement virtuel, au sein d’une CAO chirurgicale dédiée, il est possible de construire un modèle de patient virtuel sur lequel planifier l’intervention (par exemple, le placement des implants, mais aussi une régénération osseuse avec des greffes sur mesure, des lames, des maillages, ainsi que des implants analogues à la racine ou subpéristole).
Dans le cas de la chirurgie implantaire guidée, la procédure est assez simple, car immédiatement après la planification, grâce à quelques outils paramétriques et de modélisation, le logiciel de CAO disponible permet de modéliser un modèle chirurgical. Ce modèle sera produit par impression 3D ou par fraisage et utilisé cliniquement pour le placement guidé de l’implant.
Bien que les avantages de l’approche guidée en implantologie soient évidents, il est possible d’insérer des appareils dans une position, une inclinaison et une profondeur idéales, « guidés prothétiquement » et, par conséquent, d’éviter les structures anatomiques dangereuses. (nerf alvéolaire inférieur, sinus maxillaire, dents adjacentes) —à ce jour, peu de cliniciens professionnels ont systématiquement adopté la chirurgie guidée dans leur pratique clinique. La raison de tout cela doit certainement être recherchée dans les coûts plutôt élevés des systèmes disponibles à l’origine, dans leur complexité, et dans la nécessité d’utiliser des services externes pour la fabrication des modèles.
Aujourd’hui cependant, les choses ont changé, et avec un scanner intrabuccal, un CBCT, un logiciel de CAO simple avec peu d’opérateurs de modélisation paramétrique et une imprimante 3D de bureau, le clinicien peut facilement planifier ses opérations chirurgicales au sein de la clinique dentaire, sans avoir à utiliser des services externes coûteux.
Dans la présente étude clinique prospective, 20 patients partiellement édentés (9 hommes, 11 femmes; âge moyen 54,4 +/- 9,4 ans) ont été inclus. Au total, 28 modèles sélectifs à dents ouvertes ont été conçus dans le but d’insérer 38 implants. Parmi les modèles chirurgicaux, 24 présentaient un ajustement et une stabilité optimaux, 3 présentaient un ajustement optimal et une stabilité suffisante, et un seul présentait un ajustement et une stabilité inadéquats et n’était donc pas adapté à un usage clinique. Comme un seul modèle (pour un seul implant) ne convenait pas à un usage clinique, 37 implants ont été insérés chez 19 patients au moyen de modèles ouverts, sélectifs et soutenus par des dents. La durée moyenne de l’intervention était de 15,7 +/- 5,2 minutes par modèle. Aucune complication peropératoire n’a été signalée, mais un implant n’était pas stable au placement et a dû être retiré. Au total, 36 implants ont été restaurés avec 10 prothèses partielles fixes de deux unités et 16 couronnes simples. Tous les implants fonctionnaient avec succès à un an, même si dans deux couronnes simples, des complications prothétiques mineures (desserrage des vis du pilier) se sont produites.
Le résultat le plus intéressant obtenu de notre étude actuelle est la grande stabilité et l’ajustement des gabarits chirurgicaux. Bien qu’ils soient imprimés en 3D directement au bureau, à l’aide d’une imprimante 3D de bureau peu coûteuse, nos modèles chirurgicaux étaient en fait extrêmement stables et convenaient parfaitement. Ceci est essentiel pour étendre les applications de la chirurgie guidée même aux patients partiellement édentés, jusqu’à l’écart d’une seule dent, avec des modèles soutenus par une dent. Jusqu’à présent, l’application la plus fréquente de la chirurgie guidée a été représentée par des patients totalement édentés. La raison de cet excellent résultat réside dans le type particulier de conception des guides que le logiciel SMOP® CAD permet de réaliser, avec des gabarits chirurgicaux ouverts, sélectifs et soutenus par des dents (supportés par des points et non par des surfaces). Le soutien sélectif du guide par points permet en fait de réduire les conséquences négatives que les erreurs de balayage peuvent avoir. De plus, le fait que les gabarits soient ouverts permet au chirurgien de contrôler l’ajustement optimal du guide sur les surfaces occlusales directement dans la bouche. Cette conception est optimale et représente un énorme avantage par rapport à d’autres logiciels, qui dessinent des modèles fermés conventionnels pris en charge par les surfaces; dans de tels cas, une erreur de balayage unique ou une imperfection d’impression, en fait, peut entraîner l’instabilité du modèle, qui pointera sur certaines surfaces et basculera. Un modèle complètement fermé ne permet pas non plus de contrôler l’ajustement des contacts occlusaux et force le clinicien à travailler « à l’aveugle ». Enfin, les guides complètement fermés et soutenus en surface nécessitent des imprimantes 3D très puissantes pour la fabrication, afin de réduire les effets des erreurs d’impression sur la stabilité finale du modèle. Dans la présente étude, d’autre part, nous avons montré comment, avec un modèle ouvert avec des supports sélectifs, il est possible de produire des modèles chirurgicaux de haute stabilité directement au bureau et à faible coût, sans avoir à recourir à des services externes.
L’imprimante utilisée dans le cadre de cette étude était un XFAB2000®, produit par DWS, caractérisé par une technologie SLA exclusive, dotée d’un laser BluEdge® extrêmement précis et précis, étalonné pour obtenir des surfaces lisses qui ne nécessitent pas de post-production. L’imprimante a une surface de travail cylindrique de 180 mm de diamètre et peut utiliser 12 résines exclusives ; par rapport à elles, l’épaisseur de la couche est variable et peut atteindre jusqu’à 60 microns. L’imprimante est équipée d’un logiciel paramétrique (Nauta®) pour la génération automatique des supports nécessaires à l’impression. Grâce à ce logiciel, le clinicien peut rapidement dessiner les supports et les optimiser en fonction de ses besoins. Le logiciel permet une grande liberté pour modifier les supports et l’orientation et la position des objets à imprimer en 3D, afin de favoriser la meilleure qualité des surfaces de la sortie. Le fichier obtenu est ensuite envoyé au logiciel propriétaire Fictor® qui démarre et gère les opérations d’impression.
La plus grande stabilité des modèles chirurgicaux a naturellement le potentiel d’améliorer la précision de la chirurgie guidée, c’est-à-dire la correspondance entre la position prévue de l’implant et la position réelle de l’implant après la chirurgie. À ce jour, plusieurs études et recensions de la littérature ont montré qu’avec des modèles chirurgicaux conventionnels, fermés et soutenus en surface, il peut y avoir un écart constant entre la position prévue et la position réelle des implants après la chirurgie, même supérieure à 1 mm au niveau du collet et de l’apex du dispositif; les mêmes déviations angulaires sont cohérentes. Le développement de logiciels de plus en plus puissants et l’avènement de la numérisation intrabuccale permettent aujourd’hui d’étudier plus précisément les écarts linéaires et angulaires entre la position prévue et réelle des implants. En effet, il n’est plus nécessaire de chevaucher deux CBCTs (technique plutôt imprécise et archaïque), mais il suffit d’extraire la position prévue de l’implant à partir du logiciel guidé, comme des fichiers STL, et de la superposer sur la position réelle (réelle) des implants, capturé par une acquisition intrabuccale avec un corps en position. Le logiciel SMOP® implémente cette fonction, grâce à des bibliothèques dédiées qui contiennent également les corps de l’implant. Des études sont en cours pour vérifier si les écarts 3D entre la position prévue et la position réelle (réelle) des appareils après la chirurgie peuvent vraiment être réduits, par rapport à ce qui a été rapporté dans la littérature jusqu’à présent.
La présente étude présente des limites, en fait, bien que de conception prospective, elle fonde ses conclusions sur un nombre relativement restreint de patients inscrits, de modèles fabriqués et d’implants insérés. D’autres études prospectives sur un plus grand nombre de patients seront nécessaires pour confirmer les bons résultats obtenus dans ce travail. En outre, dans la présente étude, les patients présentant des limitations fonctionnelles et une ouverture réduite de la bouche ont été exclus; on sait que chez ces patients, la taille des gabarits chirurgicaux et la nécessité d’utiliser de longs forets peuvent représenter un problème, surtout dans les zones postérieures (première et deuxième molaires, mâchoires supérieure et inférieure). Les fonctions paramétriques du logiciel SMOP® permettent en partie de limiter le besoin d’espace vertical, en déplaçant les manchons vers les tissus mous autant que possible ; cependant, le problème de l’espace vertical demeure et sera toujours présent en chirurgie guidée, jusqu’à ce que des manchons puissent être utilisés pour guider les drills. Le manchon, en fait, « vole » au moins 5 mm d’espace pour être en mesure de conduire les forets efficacement, et cette limitation oblige le clinicien à utiliser des forets longs, incompatibles avec le traitement des zones postérieures de certains patients. En outre, le manchon réduit la visibilité et interfère avec l’irrigation osseuse appropriée, nécessaire pour éviter la surchauffe et les conséquences négatives qui peuvent en résulter, lors de la préparation du site chirurgical.